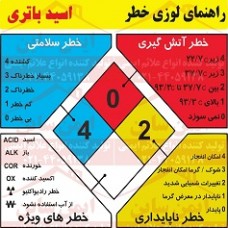
علائم ایمنی لوزی خطر اسید باتری
نام محصول علائم ایمنی : علائم ایمنی لوزی خطر اسید باتری
کد کالا علائم ایمنی : Lo 09
safety sign
| جدول فنی مشخصات تابلوهای ایمنی | |||||||
| کد سایز | ابعاد(cm) | کد برچسب | توضیحات برچسب | کد تابلو | توضیحات تابلو | ||
| S | 7*10 | D | برچسب روزرنگ-ضد آب | G | ورق گالوانیزه از 0.6 الی 2 میلیمتر ضخامت(فولاد امیرکبیر کاشان) | ||
| A | 10*15 | R | برچسب شبرنگ-ضد آب-بهمراه رفلکس نور | H | ورق پی وی سی 2الی 10 میل-ضد آب-قابلیت انعطاف پذیری | ||
| O | 15*20 | P | برچسب شبنما-ضد آب-قابلیت جذب نور و نور دهی 6 ساعت به بالا | Z | فریم الکترواستاتیک-ضخامت 1.5 میل-رنگ کوره ای-دارای لبه برگشته | ||
| M | 20*30 | X | بنر -ضد آب-بهمراه پانچ | K | ورق پلکسی 1 الی 10 میل-دارای رنگ بندی-ضد آب-مستحکم-قابلیت برش لیزر | ||
| C | 30*40 | Y | کاغذ گلاسه بهمراه لمینت | V | شاسی چوب-ضخامت 10 میل-نصب آسان به دیوار | ||
| N | 40*50 | W | برچسب شیشه ای-ضد آب | AL | آلومینیوم 1 الی 10 میل-ضد آب-دوام بالا در برابر محیط بیرونی | ||
| L | 50*60 |
جهت تماس و یا ارسال سفارش : تلگرام ،واتس آپ: 09125480830 تلفن : 02144059138-02188422701 فکس:02188457787 |
|||||
| B | 60*100 | ||||||
| Q | سفارشی | ||||||
* در صورت درخواست سایز سفارشی تابلو ایمنی برای شما مشتریان عزیز تولید خواهد شد.
* امکان اضافه شدن لوگو شرکت در گوشه کار بصورت رایگان امکان پذیر می باشد.
* قبل از تولید طرح هایی نهایی چاپ برای شما ارسال خواهد شد.
* برای انتخاب بهتر تابلوهای مورد نظر و رفع سوالات خود می توانید با همکاران ما بصورت 24 ساعته مشاوره دریافت کنید.(02144059138)
(هدف و آرزوی مجموعه ایمن ساین روزی ایمن و بدون حادثه برای شماست.)
مطالب مرتبط :
اسید باتری چیست و چه خطراتی دارد ؟
اسید باتری را می توان به هر اسیدی که در یک سلول شیمیایی یا باتری استفاده می شود، نسبت داد. اما به طور معمول این واژه برای اسیدی که در یک باتری اسید-سرب باشد، مانند اسید به کار رفته در وسایل نقلیه موتوری، استفاده می شود. به عنوان مثال اسید باتری خودرو شامل 30-50% اسید سولفوریک در آب است. معمولا این ترکیب دارای کسر مولی 29-32% اسید سولفوریک، با چگالی 1.25 – 1.28 کیلوگرم بر لیتر است.
غلظت اسید باتری در حدود 4.2-5 مول بر لیتر و میزان pH آن بسیار کم در حدود 0.8 می باشد. باتری اسید سرب اولین بار در سال 1895 توسط یک فیزیکدان فرانسوی کشف شد و اولین نوع باتری قابل شارژ می باشد. از آنجاییکه باتری اسید سرب در مقایسه با نوع جدید آن ها ارزان تر است، کاربرد بیشتری نیز دارد.
فرمول شیمیایی اسید باتری
ساختار کلی یک باتری شامل آند، کاتد، الکترولیت و جدا کننده است. یک باتری سرب-اسید از شش صفحه سربی تشکیل شده که توسط یک مایع یا ژل حاوی محلول آبی اسید سولفوریک، جدا شده است. صفحات سربی در نقش آند و کاتد عمل می کنند و محلول آبی سولفوریک اسید نیز به عنوان الکترولیت استفاده می شود. از آنجایی که اسید در آب هیدرولیز می شود بنابراین می تواند رسانای الکتریکی باشد. وظیفه اصلی الکترولیت در انتقال الکترون ها بین آند و کاتد است.
فرمول شیمیایی اسید باتری H2SO4.H2O یا H2SO4(aq) می باشد. آخرین بخش مربوط به باتری ها، جدا کننده است که به منظور جداسازی قطب مثبت و منفی استفاده می شود. انواع جدا کننده ها شامل PVC، سلولزی، پلی اتیلنی، AGM و Gel می باشند که هرکدام با توجه به ویژگی هایی که دارند در انواع مختلف باتری ها استفاده می شوند.
این باتری ها قابل شارژ هستند و با واکنش های شیمیایی شارژ و تخلیه می شوند. هنگامی که از باتری استفاده می شود (تخلیه می شود)، الکترون ها از صفحه سرب با بار منفی به صفحه دی اکسید سرب با بار مثبت منتقل می شوند.
معادله واکنش صفحه سرب با بار منفی و مثبت بصورت زیر است:
Pb (s) + HSO4– (aq) → PbSO4 (s) + H+ (aq) + 2e : صفحه منفی
PbO2 (s) + HSO4– + 3H+ (aq) + 2e– → PbSO4 (s) + 2 H2O (l) : صفحه مثبت
که اگر معادلات آن را با هم جمع کنیم معادله کلی بصورت مقابل خواهد شد:
Pb (s) + PbO2 (s) + 2 H2SO4 (aq) → 2 PbSO4 (s) + 2 H2O (l)
در ویدئوی زیر اجزا ، نحوه ساخت و نحوه عملکرد یک باتری اسید – سرب را می توان مشاهده نمود.
شارژ و تخلیه بار
زمانیکه باتری کاملا شارژ باشد، صفحه آند سرب، الکترولیت H2SO4 غلیظ و صفحه کاتد دی اکسید سرب است. اگر باتری بیش از حد شارژ شود، الکترولیز آب باعث تولید گاز هیدروژن و اکسیژن می شود که باعث می شود از بین برود.
وقتی که باتری تخلیه می شود واکنش معکوس انجام می گیرد. هر دو صفحه مثبت و منفی به سولفات سرب (ll) تبدیل می شوند، در نتیجه الکترولیت مقدار زیادی از اسید خود را از دست داده و درصد آب آن بالا می رود. اگر باتری کاملا تخلیه شود، آنگاه دو صفحه سرب سولفات کاملا یکسان داریم که با آب از هم جدا شده اند. اگر باتری به این مرحله برسد اصطلاحا به آن مرده می گویند، چرا که دیگر نمی توان آن را بازیابی کرد.
خت اسید باتری در خانه
برای ساخت باتری اسید-سرب به یک صفحه کاتدی دی اکسید سرب و یک صفحه آندی سرب نیاز است. یک لیوان شیشه ای را پر از آب کرده و دو صفحه کاتد و آند را در لیوان قرار دهید. دقت کنید که این دو صفحه با هم در تماس نباشند. سپس لیوان را با اسید سولفوریک پر کنید. مقدار اسید باید حدود 30 درصد و آب 70 درصد باشد. (در هنگام کار با اسید سولفوریک بسیار دقت کنید چرا که این ترکیب بسیار خورنده و سمی است).
حال ولتاژ ایجاد شده را اندازه بگیرید. اگر به 2 ولت رسیده بود آنگاه می توانید 5 عدد دیگر از آن را بسازید و در نهایت همه باتری های تولید شده را به صورت سری کنار یکدیگر قرار دهید تا ولتاژ 12 ولت به دست آید. لازم به ذکر است که این باتری خیلی کارآمد نیست و صرفا جهت آموزش و تجربه می تواند مناسب باشد.
خطرات اسید باتری
باتری هایی که برای کار کردن اسباب بازی ها، وسایل الکترونیکی، لوازم خانگی و وسایل نقلیه استفاده می کنید در واقع با مواد شیمیایی خطرناک پر شده اند. هنگامی که باتری خراب شود، اسید آن که مایع است می تواند نشت کند و شما را در خطر قرار دهد. از جمله آسیب های ایجاد شده می توان به سوختگی شیمیایی، مشکلات تنفسی، آسیب به چشم و… اشاره کرد.اسید به کار رفته در باتری ها سولفوریک اسید بوده که مانند هیدروکلریک اسید قدرت اسیدی بالایی داشته و سبب خورندگی می شود.
- سوختگی شیمیایی: تماس با این ترکیب می تواند منجر به ایجاد سوختگی شیمیایی شود. این نوع سوختگی ها ممکن است بلافاصله پس از تماس، ظاهر نشود. مدت زمان ظاهر شدن علائم سوختگی از چند دقیقه تا چند ساعت می تواند طول بکشد. سوزش پوست، قرمزی و یا ایجاد پوست سیاه و مرده از علائم سوختگی شیمیایی است.
- آسیب به چشم: اگر اسید باتری یا بخار اسید باتری به هرجای نزدیک چشم شما برسد، این احتمال وجود دارد که چشم های شما دچار پارگی، قرمزی و التهاب شود. در مواردی که تماس مستقیم بین چشم و اسید باتری شما وجود دارد، احتمال آسیب دیدگی چشم، ایجاد اختلال در بینایی و ایجاد کوری وجود دارد. کمک های اولیه برای سوختگی های شیمیایی در چشم شما شامل شستشوی فوری با آب به مدت 20 تا 30 دقیقه و درخواست فوریت پزشکی است.
- تحریک تنفسی: قرار گرفتن در معرض اسید سولفوریک می تواند منجر به مشکل تنفس و گرفتگی قفسه سینه شود. تنفس در هر نوع بخار اسید باتری می تواند سمی باشد و باعث سرگیجه یا حالت تهوع شود.
نوشتن نظر
نام شما:نظر شما: توجه : HTML ترجمه نمی شود!
رتبه: بد خوب
کد امنیتی را در کادر زیر وارد نمایید: